Tofersen (BIIB067), precedentemente chiamato IONIS-SOD1Rx, è una terapia sperimentale per rallentare la progressione della SLA, associata a mutazione del gene superossido dismutasi (SOD1) (SOD1-ALS). La terapia è stata sviluppata in collaborazione tra Ionis Pharmaceuticals e Biogen, ma è ora portata avanti esclusivamente da Biogen.
BIIB067 – Tofersen
L’agenzia americana del farmaco (FDA) ha approvato tofersen per il trattamento di pazienti affetti SOD1-ALS. Il farmaco sarà messo in commercio con il marchio Qalsody. Nel 2022 la casa farmaceutica Biogen aveva sottoposto la domanda per l’approvazione accelerata del farmaco nell’ambito del percorso del cosiddetto NDA (New Drug Administration). Nel 2024 anche l’Agenzia Europea del Farmaco (EMA) ha approvato l’uso di Qalsody per il trattamento di pazienti SOD1-ALS.
I risultati dell’ultimo studio clinico di fase 3 (NCT02623699) e dello nello studio di estensione open-label (OLE) (NCT03070119) condivisi da Biogen (presentazione) avevano confermato che Tofersen era in grado di ridurre i livelli totali di proteina SOD1 nel liquido cerebrospinale (CFS) e di neurofilamenti plasmatici (riduzione del 40-50%). Inoltre, l’inizio precoce del trattamento aveva rallentato significativamente il declino funzionale, della funzione respiratoria, della forza muscolare e della qualità di vita, oltre che il rischio di ventilazione permanente e morte.
Come funziona Tofersen (BIIB067)?
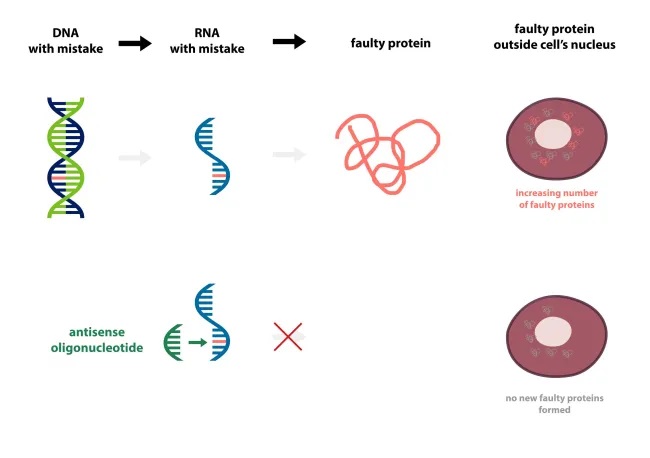
La causa esatta della malattia è sconosciuta, ma alcune forme ereditarie di SLA sono causate da una mutazione del gene superossido dismutasi 1 (SOD1). SOD1 codifica per una proteina, che neutralizza le molecole nocive dei radicali liberi dell’ossigeno. Le mutazioni in SOD1 possono indurre l’enzima ad assume una conformazione alterata, che può formare aggregati tossici che si accumulano nella cellula.
Tofersen è un oligonucleotide antisenso disegnato per legare in maniera specifica l’mRNA di SOD1 mutata (mRNA è una copia temporanea di un gene che viene utilizzato dai macchinari della cellula per produrre proteine), allo scopo di ridurre l’espressione della proteina SOD1 mutata e rallentare la progressione della malattia.
Tofersen (BIIB067) negli studi clinici
2010/2012 – Lo studio clinico di fase 1 (NCT01041222) randomizzato, in doppio cieco, controllato con placebo, ha testato quattro diverse dosi di tofersen in 33 pazienti con SLA familiare SOD1, per valutare la sicurezza, la tollerabilità e l’attività del farmaco. I partecipanti sono stati poi valutati per 28 giorni dopo il trattamento. Non sono stati osservati effetti avversi gravi in risposta al trattamento. I risultati sono pubblicati sulla rivista medica The Lancet Neurology.
2016/2021 – VALOR study parte A e B (EudraCT number, 2015-004098-33). Lo studio clinico di Fase 1/2 con dosi ascendenti di tofersen in 70 pazienti con SLA familiare e mutazioni del gene SOD1 ha messo in evidenza una diminuzione statisticamente significativa dei livelli di proteina SOD1 nel liquido cerebrospinale dei pazienti trattati e un trend positivo nel rallentare il declino funzionale (misurato con la scala ALSFRS-R), la perdita di forza muscolare e la riduzione della funzionalità respiratoria nel braccio trattato con la dose di 100 mg di tofersen rispetto al placebo. Il trattamento ha mostrato anche una riduzione dei livelli di neurofilamenti (un marcatore apparente dell’attività della malattia) rispetto al placebo
VALOR study parte C – Successivamente, un secondo e più grande studio di fase 3 (NCT02623699) randomizzato controllato con placebo, chiamato VALOR study, è stato avviato negli Stati Uniti, Canada, Regno Unito, Europa e anche in un centro italiano. Lo studio ha l’obiettivo di confermare i precedenti dati sulla sicurezza e di valutare l’effetto del trattamento sulla riduzione del declino funzionale in 108 pazienti con mutazioni di SOD1. Lo studio è terminato nella metà del 2021.
Lo studio VALOR non ha raggiunto il suo obiettivo primario che consisteva in un cambiamento statisticamente significato alla settimana 28 sulla scala di valutazione funzionale ALSFRS-R). Tuttavia, è stata osservata nei pazienti un rallentamento nella progressione della malattia e altri dati secondari hanno mostrato una riduzione dei livelli della proteina SOD1 nel liquido spinale cerebrale (prova del fatto che tofersen abbia raggiunto e bloccato l’espressione della sua proteina bersaglio) e una riduzione della catena leggera del neurofilamento nel plasma (NfL), un biomarcatore di degenerazione neuronale.
Sebbene l’endpoint primario non sia stato raggiunto, la maggioranza dei partecipanti allo studio VALOR (95 dei 108 originali) ha optato per entrare nello studio di estensione open-label (OLE) in corso (NCT03070119) durante il quale riceveranno tofersen per un massimo di sette anni. Altri pazienti con SLA hanno scelto di ottenere l’accesso anticipato a tofersen attraverso il programma di uso compassionevole di Biogen.
In una recente presentazione, Biogen ha condiviso dei dati incoraggianti a 12 mesi che hanno comparato i risultati dei pazienti che hanno iniziato il trattamento all’inizio del trial VALOR con quelli che lo hanno iniziato più tardi (sei mesi dopo) nella fase open-label (OLE). I risultati hanno confermato che Tofersen ha ridotto i livelli totali di proteina SOD1 nel liquido cerebrospinale (CFS) e di neurofilamenti plasmatici (riduzione del 40-50%) sia nel gruppo di avvio precoce che in quello di avvio ritardato. In particolare, coloro che hanno ricevuto il trattamento all’inizio dello studio VALOR hanno mostrato che i livelli ridotti di SOD1 nel CSF e i NfL sono stati mantenuti nei sei mesi di trattamento aggiuntivi. Inoltre, l’inizio precoce del trattamento ha rallentato significativamente il declino funzionale, della funzione respiratoria, della forza muscolare e della qualità di vita, oltre che il rischio di ventilazione permanente e morte.
I risultati sono stati recentemente pubblicati sul New England Journal of Medicine (NEJM).
2021/2027 – Tofersen è anche studiato nello studio di fase 3 ATLAS (NCT04856982), che intende valutare se il trattamento sia in grado di ritardare l’inizio dei sintomi clinici della malattia quando il trattamento viene iniziato in una fase presintomatica in 150 pazienti con mutazione di SOD1 ed elevati livelli di NFL.
2023 – Il Qalsody (tofersen) è stato approvato da FDA (Food and Drug Administration) come nuovo farmaco per le persone con SLA che hanno la mutazione del gene SOD1.
2024 – Il Qalsody (tofersen) è stato approvato da EMA (Agenzia Europea del Farmaco) come nuovo farmaco per le persone con SLA che hanno la mutazione del gene SOD1.
Ultimo aggiornamento: agosto 2024